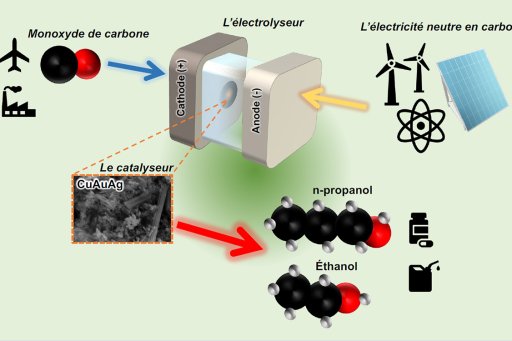
La transformation du dioxyde de carbone (CO2) en molécules carbonées pour l’industrie chimique (alcools par exemple) et en carburants (hydrocarbures de type alcènes ou alcanes, par exemple) constitue une stratégie de plus en plus développée dans les laboratoires académiques et industriels. En effet, s’affranchir des sources carbonées fossiles traditionnelles, et développer des procédés de synthèse chimique à partir de nouvelles sources de carbone, constitue une réponse à la crise climatique.
Le CO2 de l’atmosphère, ou plus sûrement celui capturé dans les grands centres industriels d’émission de ce gaz (raffineries, cimenteries, centrales thermiques, etc.), peut être l’un de ces précurseurs carbonés de nature à nous faire basculer vers une chimie plus verte. Si par ailleurs l’énergie utilisée pour les réactions de transformation du CO2 est une énergie renouvelable et intermittente, de tels procédés ont l’avantage de permettre un stockage de cette énergie sous une forme chimique durable. Ainsi les transformations discutées dans cette publication peuvent utiliser de l’énergie électrique « solaire » pour alimenter un électrolyseur où le CO2 est converti (par électroréduction) en produits carbonés divers. Ces électrolyseurs utilisent l’énergie électrique pour oxyder l’eau (et produire ainsi du dioxygène et des ions hydrogène) à une électrode (anode) et réduisent le dioxyde de carbone à l’autre électrode (cathode), où se produit également une réduction des ions hydrogène en gaz hydrogène.
En raison de la grande stabilité du CO2 et de la complexité des réactions de sa transformation, la mise en oeuvre pratique de ces procédés nécessite le développement de catalyseurs efficaces, peu coûteux, stables et sélectifs. Le métal le plus prometteur pour les électrocatalyseurs de demain est le cuivre, mais celui-ci souffre encore de défauts majeurs : efficacité insuffisante et faible sélectivité. En particulier, la réduction de l’eau utilisée comme solvant « vert » dans ces dispositifs entre en compétition avec la réduction du CO2, car l’eau est plus efficacement transformée en hydrogène. Cette concurrence conduit à des rendements en produits carbonés trop faibles pour être rentables.
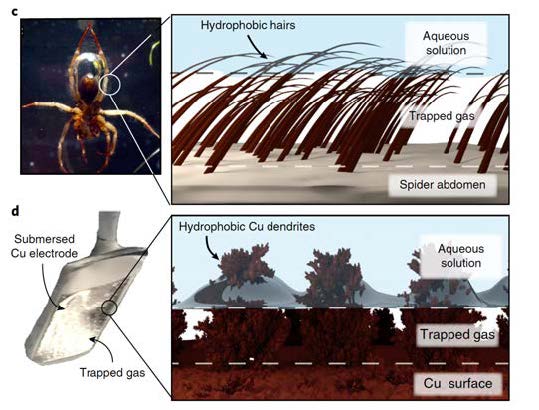
Effet plastron. Utilisation d'une surface hydrophobe pour piéger une couche de gaz au niveau de l'interface solution-solide. Ceci est illustré par la respiration subaquatique d’une araignée en plongée (en haut à gauche) et par une surface hydrophobe en cuivre dendritique servant de catalyseur pour l’électroréduction du CO2 aqueux (en bas à droite). La photo de l'araignée est adaptée de Seymour et Hetz, avec l'autorisation de la Fondation The Company of Biologists.
L’équipe de Marc Fontecave, professeur au Collège de France et titulaire de la chaire Chimie des processus biologiques, et de Victor Mougel, chargé de recherche du CNRS, vient de développer une nouvelle stratégie pour rendre des matériaux catalytiques à base de cuivre beaucoup plus sélectifs pour la réduction du CO2 en hydrocarbures. Cette stratégie tire une partie de son originalité dans le fait qu’elle s’inspire d’une stratégie naturelle développée par les araignées aquatiques pour maintenir, sous l’eau, à la surface de leur abdomen et de leurs pattes, des bulles d’oxygène leur permettant de respirer dans l’eau. Pour cela, elles utilisent l’« effet plastron » qui met à profit la pilosité de surface de leurs pattes et abdomens, hautement hydrophobes, donc repoussant l’eau et retenant efficacement des bulles d’oxygène.
Considérant qu’une des clés pour l’amélioration de la sélectivité des catalyseurs à base de cuivre résidait d’une part dans l’accumulation du gaz CO2 et d’autre part dans une élimination de l’eau à la surface du matériau, les chercheurs se sont inspirés de cet « effet plastron » décrit ci-dessus. En attachant simplement sur cette surface une couche de fils hydrophobes (ici des chaines alkyles), qui d’une certaine façon miment les poils de l’araignée, ils ont radicalement changé la sélectivité de ce catalyseur favorisant la transformation du CO2 au détriment de la réduction de l’eau. Le résultat est impressionnant : alors que le catalyseur non modifié produit de l’éthylène avec un rendement faible de 9 % et de l’éthanol avec un rendement de 4 %, le catalyseur modifié produit de l’éthylène avec un rendement de 56 % et de l’éthanol avec un rendement de 17 %, s’accompagnant d’une chute drastique du rendement en hydrogène. L’éthylène et l’éthanol sont des produits particulièrement intéressants pour l’industrie chimique. En effet, le premier est le précurseur d’un grand nombre de polymères tandis que le second est à la fois un produit de base de l’industrie et un carburant. Sur un plan plus fondamental, ces travaux montrent pour la première fois de façon très claire l’importance de l’hydrophobicité des surfaces des matériaux catalytiques pour une transformation sélective du CO2. Ils ouvrent des perspectives nouvelles en matière d’optimisation des catalyseurs pour les électrolyseurs de demain.

Le Pr Marc Fontecave est le titulaire de la chaire Chimie des processus biologiques du Collège de France.
Il est directeur du Laboratoire de chimie des processus biologiques (CNRS/Collège de France) et a reçu la médaille d’argent du CNRS en 2004.